Тепловой аккумулятор на основе сульфата натрия
Экология потребления.Наука и техника: Теплоаккумулятор с использованием раствора сульфата натрия обеспечивает значительно в 8-10 раз большее количество запасаемого аккумулятором тепла, по сравнению с простой водой
Проблемы накопления и сохранения тепла по прежнему актуальны и весьма заманчиво решить их с помощью на простого нагрева какого либо теплоемкого тела, а с использованием физических особенностей перехода вещества из одного агрегатного состояния в другое. Известно, что количество тепла, необходимое для, например, плавления льда в воду эквивалентно количеству тепла необходимому для нагрева этой же воды на 80 (!) градусов.
К сожалению, число веществ, изменяющих свое агрегатное состояние в диапазоне температур солнечного коллектора (40-70 гр.С) не так велико. Да и те - достаточно дороги. Это прежде всего - парафины. Можно составить смесь парафинов плавящихся в этом диапазоне температур. Но парафины достаточно дороги (>1$US за килограмм). К счастью, есть и другое вещество - сульфат натрия или глауберова соль.
Поскольку в строящемся мною доме предполагается активно использовать тепловой аккумулятор (совместно с солнечным коллектором и отопительными приборами), то есть смысл рассмотреть возможную реализацию его на основе глауберовой соли или сульфата натрия.
Подробнее, что такое сульфат натрия вы можете узнать, набрав в любом поисковике запрос «сульфат натрия» или «глауберова соль», я лишь упомяну об одном замечательном свойстве этого минерала, вернее одной его разновидности – т.н. десятиводном сульфате. Десятиводный он потому, что каждая его молекула «связывает» вокруг себя 10 молекул воды. В результате чего сульфат начинает растворяться в собственной воде с ростом температуры с огромным поглощением тепла. При температуре +32 градуса он становится густой жидкостью. А при охлаждении ниже этой температуры может начать кристаллизоваться и отдавать тепло назад. Количество тепла достаточно велико - 78,5 кДж/моль. Что эквивалентно количеству тепла, запасаемого водой, например (4,2 кДж/кг*град) в диапазоне либо несколько десятков градусов (!) одним литром, либо десятками литров воды!
«Может» - потому, что если насыщенный раствор сульфата натрия находится а абсолютном покое, то кристаллов не образуется. Но если его переохлажденный раствор сотрясти или как то побеспокоить, то начинается лавинообразная кристаллизация с сильным разогревом. Раствор быстро нагревается до +32 и поддерживает эту температуру, пока весь не кристаллизуется. Т.е. в зависимости от обстоятельств и желания, можно получить запасенное тепло либо сразу, по мере остывания. А можно – по желанию, вызвал кристаллизацию переохлажденного раствора.
Эти замечательные свойства, разумеется, открыл не я, они давным-давно известны и используются исследователями альтернативных источников энергии. Вот и я решил провести кое-какие эксперименты. Для чего было закуплено некоторое количество глауберовой соли.
Приготовление раствора.
Глауберова соль продается в обезвоженном виде (иначе ее было бы очень трудно хранить). Поэтому я взял примерно 2 литра горячей воды и начал растворять в ней сульфат натрия до состояния насыщенного раствора (т.е. до тех пор, пока соль не перестанет растворяться). В 2-х литрах растворилось примерно 600-650 мл соли. (мне удобно пользоваться объемными мерами, ввиду отсутствия точных весов). Плотность сульфата - примерно 1,5 Кг/литр, т.е. в литре растворилось примерно 450-480 грамм (что близко к справочным показателям - максимальная его растворимость в воде при 32,4° С, которая составляет 49,8 г в 100 г воды (в расчете на безводную соль). После тщательного двойного процеживания раствора через фильтровальную бумагу (фильтры для кофеварки), я приступил к опытам.
Важно было максимально точно воспроизвести условия, в которых будет «работать» раствор сульфата натрия в условиях теплового аккумулятора. Как то: абсолютная неподвижность ( в подвале канистры с раствором никто беспокоить не будет); достаточно медленные процессы нагрева и охлаждения, поэтому охлаждение осуществляется естественным образом, а нагрев - очень маломощной электрической грелкой, которой я оборачивал бутылку с раствором.
Контроль температуры производился с помощью лабораторного ртутного термометра (к сожалению, электронного в выносным датчиком под рукой не оказалось). Что бы измерять температуру раствора, и при этом не вмешиваться в раствор, пришлось сбоку бутылки приделать специальную П-образную «капсулу» из пенополистирола, в которую вставлялся термометр так, что бы своей колбой с ртутью касаться стенки бутылки. Для улучшения теплопередачи от бутылки к термометру я туда натолкал алюминиевой фольги. Впрочем, важно было отследить динамику температур в различных условиях, а не ее абсолютные значения.
Проведение экспериментов.
Нагрев с помощью электрической грелки раствор до 45 градусов (примерно до такой температуры я рассчитываю заряжать свой теплоаккумулятор в эко-доме) я установил ее место, где она на подвергалась вибрациям, дополнительному нагреву или охлаждению и достаточно прохладное место. Т.е. в погребе (фактически - подвал дома и будет погребом, так что условия схожи). Температура окружающего воздуха +10 градусов.
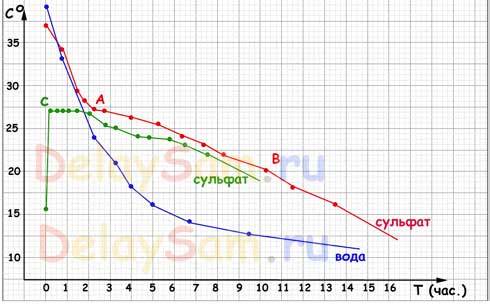
Результаты проведенных испытаний вы видите на графике:
Пояснения:
Синий график – график остывания воды. Как видите, тут никаких «приключений». Вода остывает по обратной экспоненте, стремясь к температуре окружающего ее воздуха. И чем меньше разница температуры между водой и воздухом, тем медленнее идет остывание.
График остывания раствора соли БЕЗ инициализации кристаллизации совершенно повторяет график остывания воды. Поэтому я даже не стал его рисовать.
Красный график - график остывания насыщенного раствора с внесенной затравкой. Дело в том, что для того, что бы началась естественная кристаллизация в растворе, необходимо наличие какой-либо неоднородности. Обычно ею служит некоторое количество нерастворенной соли на дне сосуда. Т.е. раствор немного пересыщен. По мере остывания раствора, в точке «А» началась кристаллизация соли в бутылке и процесс остывания резко замедлился. Тепло, выделяющееся при кристаллизации нагревало сам раствор и компенсировало теплопотери. Так продолжалось до точки «В».
Следует учитывать, что я фактически измерял не температуру раствора, а температуру поверхности бутылки. Но именно это и важно, поскольку воздух в теплоакккумуляторе будет контактировать не с раствором, а именно с поверхностью канистр, в которых будет находится теплоаккумулирующее вещество, вода или раствор сульфата натрия.
В точке «В» кристаллы заняли примерно 4/5 объема бутылки и выделение тепла замедлилось, хотя ее верхняя часть все еще была на ощупь ощутимо теплее той зоны, в которой находился термометр. Очевидно, что просто передача тепла внутри самой бутылки замедлилась и термометр перестал фиксировать ее.
Зеленый график - график поведения переохлажденного раствора. Раствор без затравки был просто охлажден до +15, а на следующие сутки в нем была вызвана кристаллизация (фактически – прикосновением к бутылке). Сразу начали расти кристаллы по всему объему бутылки, а бутылка фактически мгновенно разогрелась до 27 градусов (наружная температура поверхности). После разогрева часть кристаллов снова «расплавилась» и раствор перешёл в равновесное состояние. Т.е. кристаллизовалась только та часть раствора, необходимая на поддержание температуры равновесия.
Выводы.
Как видим из графиков, теплоаккумулятор с использованием раствора сульфата натрия обеспечивает значительно большее количество запасаемого аккумулятором тепла, практически в 8-10 раз, по сравнению с простой водой. Причем температура раствора находится в самой комфортной температурной зоне для человека - + 20-27 градусов!
Формально можно сказать, что 100 литров раствора могут заменить примерно 1 тонну воды по теплоемкости.
Но наряду с этим достоинством проявляются и его определенные особенности. Не хочу писать «недостатки» потому что они могут обернутся и дополнительными достоинствами, смотря как ими распорядиться.
В частности, достаточно трудно вызвать «монотонную» кристаллизацию раствора, т.е. естественную, в процессе остывания. Это можно сделать затравкой, но тогда процесс становится неуправляемым. Поэтому, очевидно придется придумать какой то прибор с термодатчиком, который бы срабатывал и вызывал кристаллизацию раствора при его охлаждении, например до 20-24 градусов. С другой стороны, следует предусмотреть возможность управления этим прибором вручную. Тогда в ситуации, когда тепловой аккумулятор разряжен до 20 градусов и хотелось бы поднять его температуру за счет кристаллизации раствора сульфата, НО прогноз погоды в ближайшее день-два обещает потепление или просто солнечные дни, которые позволят подзарядить теплоаккумулятор, можно будет лучше немного «потерпеть», но сохранить потенциал ТА полностью. И в конце-концов, ТА - это не один большой бассейн, а набор емкостей с водой или раствором сульфата. И кто мешает организовать достаточно гибкое управление им, что бы начинать кристаллизацию раствора по частям.
Так же следует провести и небольшой экономический анализ целесообразности применения сульфата натрия. Он хотя и недорог, но не бесплатен. Стоимость его – 7-8 рублей за килограмм. А 1 килограмм соли (сухой) дает нам 2,5 литра насыщенного раствора.
Допустим, мы купили 1 тонну соли, что даст нам 2500 литров раствора. И обошлось нам это примерно в 8000 рублей. Теперь давайте сравним.
8000 рублей - это примерно 5000 чистых кВт электроэнергии, или 18.000 МДж тепла. КПД электронагревателей близко к 100%.
8000 рублей - это примерно 5 кубометров дров (3000 кг). Это, с учетом КПД печи даст нам примерно 20.000-25.000 МДж тепла
Просто бесплатная вода (2500 литров) остывая с 40 градусов до 20 (когда еще есть смысл отнимать у нее тепло для обдува помещения воздухом такой температуры) Не отдает 200 МДж
А 2500 литров сульфата натрия дадут нам тепла соответственно в 6 раз (берем по минимуму) больше. Т.е. 200 х 6 = 1200 МДж.
Получается, что прежде чем затраты на сульфатный теплоаккумулятор окупятся, он должен будет совершить как минимум полных «оборотов» 15 по сравнению с электричеством, и 20 по сравнению с дровами.
С одной стороны, затраты на теплоаккумулятор являются разовыми и будут «отбиваться» достаточно долго, очевидно 2-3 года. А за электричество можно платить малыми дозами, и дрова можно использовать «случайные» - валежник вдоль дорог, всякое деревянное старье и отходы. А с другой стороны, и дрова, и электричество можно сжечь только 1 раз. И потом придется вновь тратить очередные «8000 тысяч» на них. А теплоаккумулятор будет служить долгие годы, возможно – десятилетия…
Поэтому тут уж каждый решает сам - стоит ли тратиться на сульфат натрия, или просто увеличить объем обычного водяного теплоаккумулятора в 6-10 раз, и строить ли его вообще… Очевидно, что использование сульфата - выход для тех, кто не может себе позволить достаточно объемный теплоаккумулятор на обычной воде или гравийно-каменнный.опубликовано econet.ru
P.S. И помните, всего лишь изменяя свое потребление - мы вместе изменяем мир! © econet
Присоединяйтесь к нам в Facebook , ВКонтакте, Одноклассниках
Источник: https://econet.ru./
Понравилась статья? Напишите свое мнение в комментариях.

Хороший материал! Дальнейшие эксперименты проводились? Опытный образец? Хотел бы внести свою лепту в приведенные сравнения. 25000МДж (дрова на 8000руб) - тепло, необходимое для годового отопления хорошо утепленного дома. 200Мдж (2,5м3 солевого раствора) - как-то совсем маловато для запаса на зимний сезон. Мы же говорим о сезонном аккумуляторе, иначе где еще брать бесплатное тепло, как не летом. Похоже нужно кубов 200 воды (котлован под всем домом 10х10 глубиной в 2м). Это получается по данным расценкам соли на 640 тыс рублей (80 тонн). И это по старым расценкам, на сегодня уже раза в три больше. 80 тонн соли - это чуть больше вагона. Тут надо уже самому заморачиваться с поставкой из мест, где эта соль бесплатно лежит.
Ответить250 000 МДж - тепло, необходимое для годового отопления хорошо утепленного дома.
ОтветитьА какой объём этого дома?
Продолжительность отопительного сезона.
Средние темпеоатуры в месяцы отопительного сезона
Добавить комментарий