Моделирование фотосинтеза
Экология потребления.Наука и техника:Попыткам не просто воспроизвести процесс фотосинтеза, а превзойти его и поставить на широкую ногу уделяется так много внимания со стороны учёных.
Когда думаешь о гениальности Природы (кто бы и какой бы смысл не вкладывал в слово Природа), хочется сказать, что её венец – это человечество, отдельные особи которого, гордо возложившие ноут на пузо, занимаются тем, о чём ещё несколько десятков лет можно было только мечтать: общаются со всем миром!
Но с экологической точки зрения наш вид – лишь консумент одного из самых высоких порядков, почивающий на лаврах тех, кто создаёт биомассу из неживого, т.е. на лаврах братьев наших автотрофных – растений.
Замечу, что подавляющее большинство растений является не просто автотрофами, а фотоавтотрофами, т.е. для синтеза органических соединений из неорганических использует энергию фотонов, источником которых является Солнце. Неудивительно, что попыткам не просто воспроизвести процесс фотосинтеза, а превзойти его и поставить на широкую ногу уделяется так много внимания со стороны учёных.
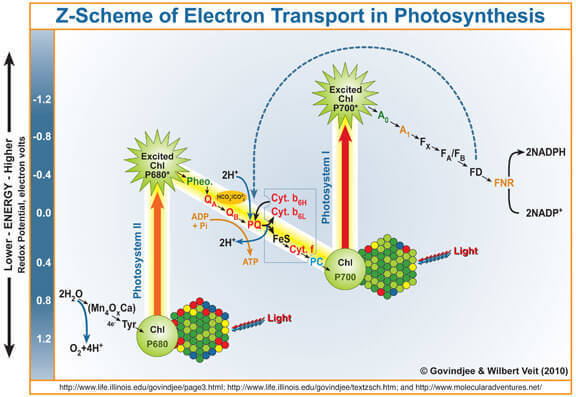
Как известно, побочным продуктом фотосинтеза является кислород, образующийся при окислении воды под действием фотосистемы II (ФС II). Вкратце и упрощённо напомню, как она работает.
Квант света попадает на хлорофилл а, выбивает из него электрон. Этот электрон далее в конечном итоге попадает в фотосистему I, а лишённый его хлорофилл а, ставший сильным окислителем, забирает через марганецсодержащий водоокисляющий комплекс (ВОК) электроны у воды, в результате чего и образуется кислород.
Таким образом, ВОК можно рассматривать как катализатор процесса окисления воды. Именно имитацией этой части ФС II исследователи занимаются весьма активно.
Надо сказать, что потенциально (т.е. термодинамически) воду окислить может любой окислитель, чей электродный потенциал выше её электродного потенциала. К примеру, перманганат калия (E°=+1,51 В для полуреакции MnO4-+5e-+8H+ → Mn2+ +4H2O). Вы сами можете посмотреть таблицу стандартных электродных потенциалов и убедиться, что есть и другие примеры. Однако на практике этого не происходит по кинетическим причинам, иными словами, из-за высокой энергии активации скорость этого процесса очень мала. Именно поэтому разработка катализатора для окисления воды актуальна, а биомиметический подход является перспективным.
В гомогенном катализе (т.е. в каталитической реакции, при которой катализатор находится в той же фазе, что и реагенты, на практике – преимущественно в жидкой) активность катализатора принято оценивать таким параметром как «частота оборотов» (TOF, turnover frequency), т.е. числом молекул реагента, превращённых одной молекулой катализатора (точнее – активным центром) в единицу времени, имеет размерность с-1. ВОК ФС II имеет TOF порядка 100-400 с-1.
Исследователи из университета города Вюрцбурга в качестве катализатора окисления воды решили использовать комплекс рутения, содержащий 3 атома этого элемента [Ru(bda)bpb]3.
«Почему рутений?» — спросите вы, и я отвечу: видимо потому, что набор степеней окисления этого элемента (+2, +3, + 4, +5) до боли напоминает набор степеней окисления марганца, которые, как полагают исследователи, принимают его атомы в ВОК при окислении воды.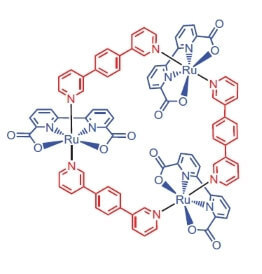
Что умеет делать этот благородный красавчик?
В водно-ацетонитрильной смеси при рН=1 он умеет катализировать окисление воды нитратом аммония-церия (IV) (E°=+1,72 В для полуреакции Ce4++e- → Ce3+). Как только этот сильный окислитель добавляется в систему, содержащую небольшие количества катализатора, сразу же начинается выделение пузырьков кислорода, концентрация которого в газовой фазе над раствором резко увеличивается! TOF этого катализатора близка к эффективности природного ВОК и составляет порядка 160 с-1. Протекает реакция: 2Ce4+ + H2O → 2Ce3+ + 1/2O2 + 2H+.
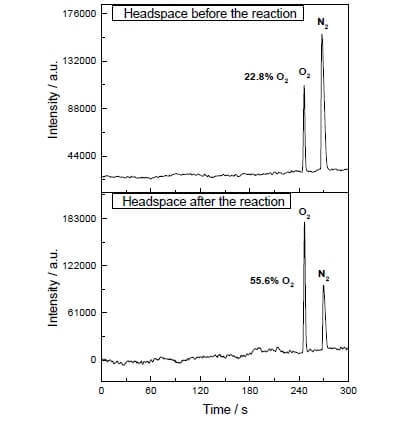
Однако на этом учёные не остановились. Исследователи решили сконструировать систему, которая бы работала фотохимически, т.е. в некотором роде имитировала бы работу ФС II. Вторым ключевым игроком этой биомиметической конструкции стал ещё один комплекс рутения в качестве фотосенсибилизатора. Вот как она работает.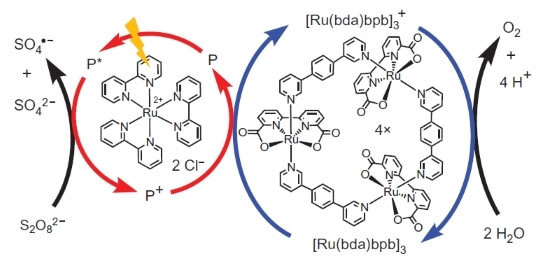
Фотон (показан в виде молнии) выбивает электрон из фотосенсибилизатора (кружок из красных стрелок). Электрон «идёт налево», к внешнему акцептору, пероксодисульфату натрия (E°=+2,01 В для полуреакции S2O82-+2e- → 2SO42-), а дырка, которая в нашем случае представлена атомом рутения со степенью окисления (+3), окисляет катализатор (кружок из синих стрелок), который в свою очередь отбирает электрон от воды. Таким образом, суммарное уравнение протекающей реакции будет: S2O82-+H2O → 2SO42- + 1/2O2 + 2H+.
В чём преимущество созданного немецкими исследователями катализатора?
1) Он весьма активен (enters a very small and elite group of catalysts capable of achieving TOFs in excess of 100 s–1). В фотохимическом процессе выделение кислорода заметно уже при концентрации катализатора порядка 90 нМ, т.е. 90×10-9 моль/л.
2) За счёт того, что каталитически активные атомы рутения прочно связаны, как муха в паутине, полидентатными лигандами, комплексный катализатор стабильнее своих моноядерных аналогов.
Стабильность катализатора характеризуется таким параметром как «число оборотов» (TON, turnover number) – числом каталитических циклов, которые может провернуть активный центр до момента дезактивации (прекращения работы). В реакции окисления воды под действием Ce(IV) TON составляет для него около 7400 против 1000 для моноядерных аналогов. Правда, в случае фотохимического процесса TON пониже (устойчивость меньше) – около 1200.
Ну и о недостатках.
Статья о находке нового катализатора напечатана в журнале из семейства Nature (Nature Chemistry), где публикуются передовые и самые важные для химического сообщества и, надо полагать, для человечества работы и достижения (импакт фактор за 2014 год – 25,3).
Итак. Всё, что на сегодняшний день способно сделать человечество, – это с помощью не самого дешёвого металла рутения (в природе работает дешёвый марганец) в 0,1 н серной кислоте (рН=1, примерно такая кислотность, чуть ниже, в желудке; окисление воды в природе идёт при рН, близких к 7) и 60 % ацетонитрила (органический растворитель, который не требуется хлоропластам) дать десятки микромолей кислорода в секунду. Зато есть к чему стремиться! опубликовано econet.ru
P.S. И помните, всего лишь изменяя свое потребление - мы вместе изменяем мир! © econet
Присоединяйтесь к нам в Facebook , ВКонтакте, Одноклассниках
Источник: https://econet.ru./
Понравилась статья? Напишите свое мнение в комментариях.
Добавить комментарий